 Разделы физики
Разделы физики
Термодинамика
Тепловые процессы и их законы.
Внутренняя энергия
Внутренняя энергия одноатомного газа:
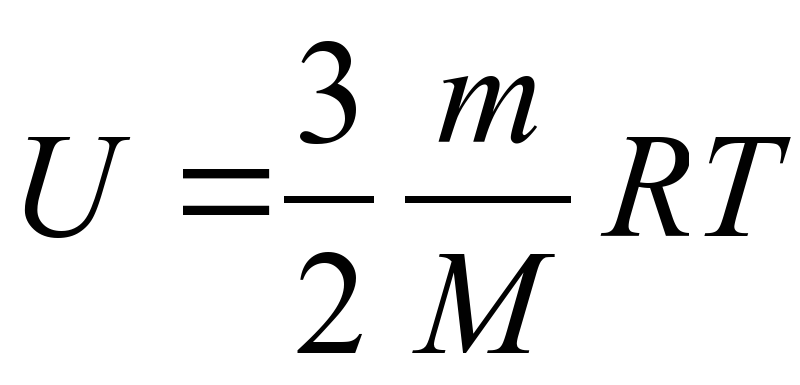
Пояснение:
U - внутренняя энегрия (Дж)
m- масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
T - температура (К)
m- масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
T - температура (К)
Изменение внутренней энергия одноатомного газа:
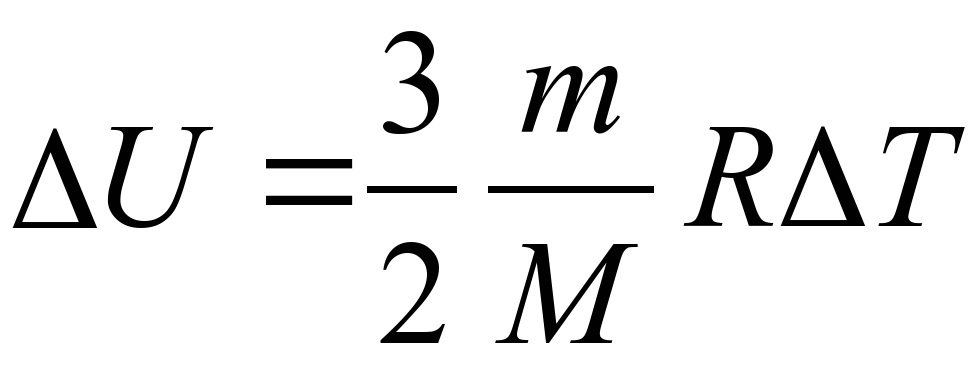
Пояснение:
ΔU - изменение внутренней энегрии (Дж)
m- масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
m- масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
Внутренняя энергия двухатомного газа:
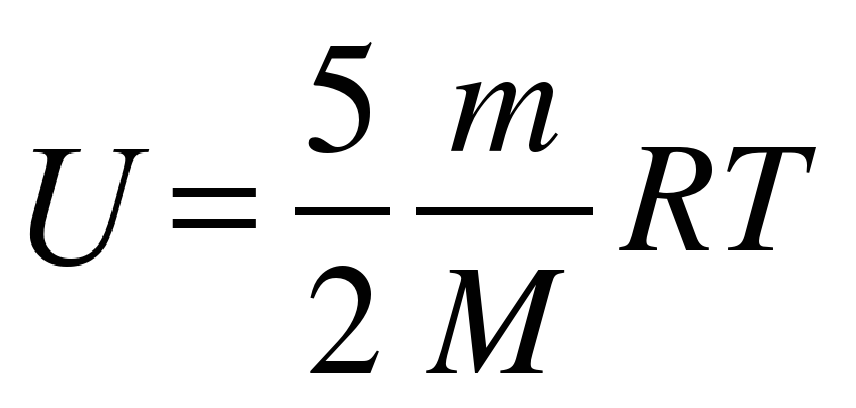
Пояснение:
U - внутренняя энегрия (Дж)
m- масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
T - температура (К)
m- масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
T - температура (К)
Изменение внутренней энергия двухатомного газа:
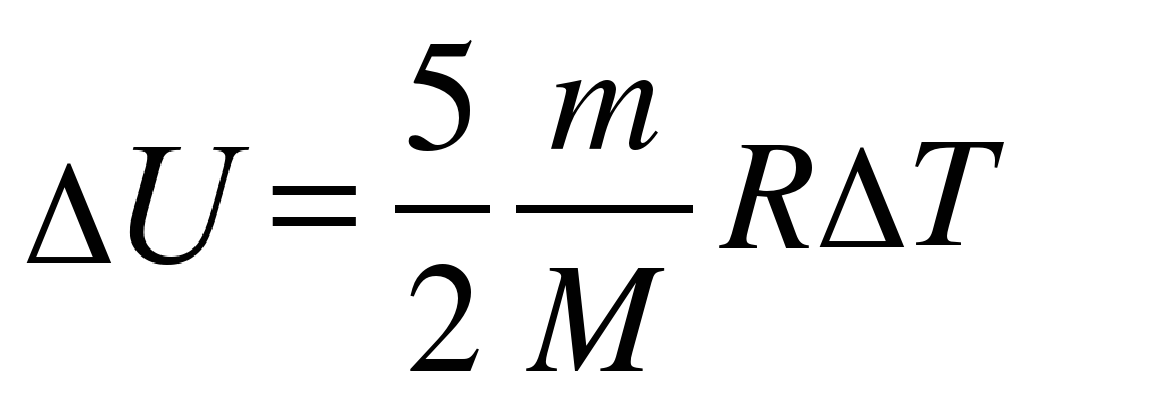
Пояснение:
ΔU - изменение внутренней энегрии (Дж)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
Работа в термодинамике
Работа идеального газа:
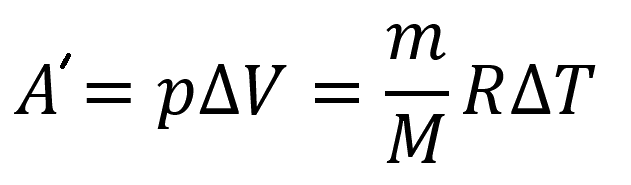
Пояснение:
A` - работа идеального газа (Дж)
p - давление идеального газа (Па)
ΔV - изменение объёма идеального газа (м³)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
p - давление идеального газа (Па)
ΔV - изменение объёма идеального газа (м³)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
Изменение внутренней энергия одноатомного газа:
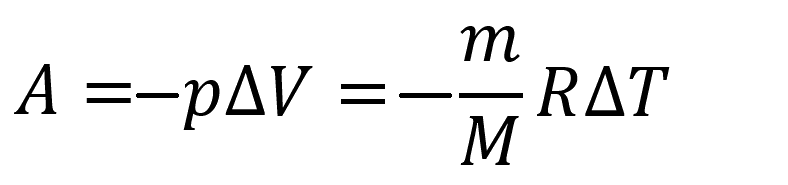
Пояснение:
A - работа над идеальным газом (Дж)
p - давление идеального газа (Па)
ΔV - изменение объёма идеального газа (м³)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
p - давление идеального газа (Па)
ΔV - изменение объёма идеального газа (м³)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
ΔT - изменение температуры (К)
Соотношение работ газа и над газом:
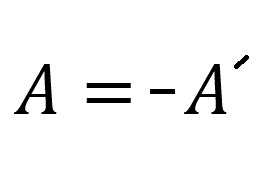
Пояснение:
A - работа над газом (Дж)
A` - работа газа (Дж)
A` - работа газа (Дж)
Количество теплоты
Количество теплоты при кристализации:
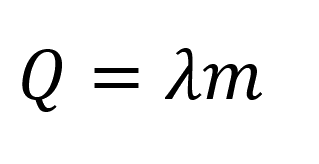
Пояснение:
Q - количество теплоты (Дж)
λ(лямбда) - удельная теплота плавления вещества (Дж/кг)
m - масса тела (кг)
(значения λ в таблице)
λ(лямбда) - удельная теплота плавления вещества (Дж/кг)
m - масса тела (кг)
(значения λ в таблице)
Количество теплоты при конденсации:
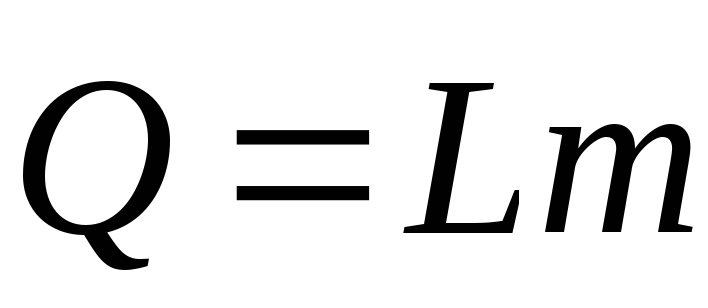
Пояснение:
Q - количество теплоты (Дж)
L(r) - удельная теплота парообразования (Дж/кг)
m - масса тела (кг)
(значения L в таблице)
L(r) - удельная теплота парообразования (Дж/кг)
m - масса тела (кг)
(значения L в таблице)
Количество теплоты при сгорании:

Пояснение:
Q - количество теплоты (Дж)
q - удельная теплота сгорания топлива (Дж/кг)
m - масса тела (кг)
(значения q в таблице)
q - удельная теплота сгорания топлива (Дж/кг)
m - масса тела (кг)
(значения q в таблице)
Количество теплоты при нагревании или охлаждении:
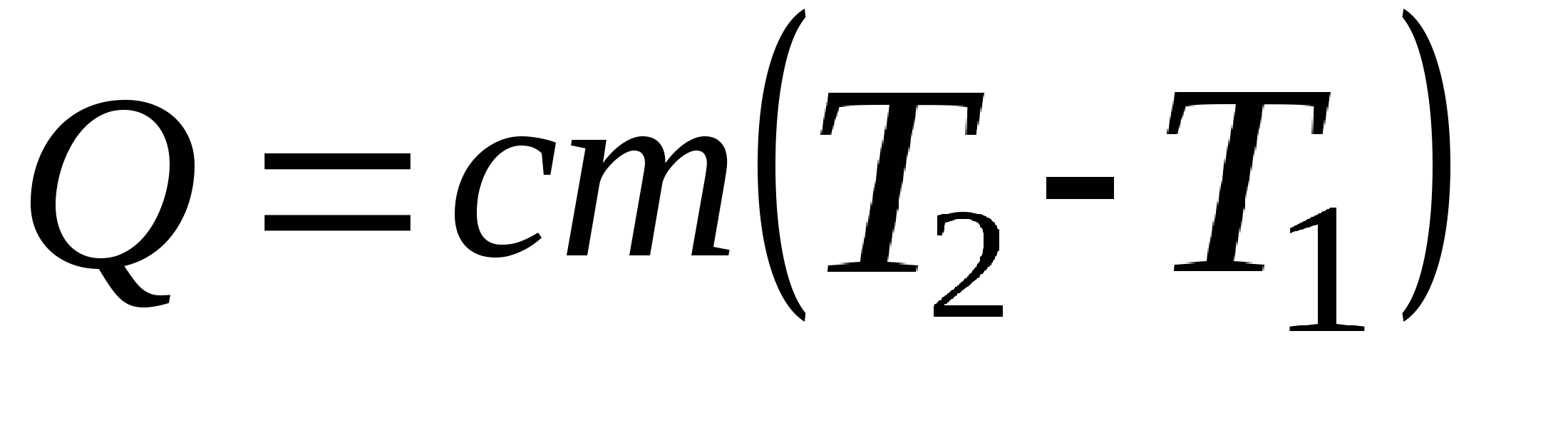
Пояснение:
Q - количество теплоты (Дж)
c - удельная теплоёмкость вещества (Дж/(кг·К))
m - масса тела (кг)
T2 - конечная температура (К)
T1 - начальная температура (К)
(значения c в таблице)
c - удельная теплоёмкость вещества (Дж/(кг·К))
m - масса тела (кг)
T2 - конечная температура (К)
T1 - начальная температура (К)
(значения c в таблице)
Теплоёмкость вещества:

Пояснение:
С - теплоёмкость вещества (Дж/К)
c - удельная теплоёмкость вещества (Дж/(кг·К))
m - масса тела (кг)
(значения c в таблице)
c - удельная теплоёмкость вещества (Дж/(кг·К))
m - масса тела (кг)
(значения c в таблице)
Уравнение теплового баланса (ЗСЭ):

Пояснение:
Qотд - количество теплоты выделяённое (отданное) телом в окружающую среду. (Дж)
Qпогл - количество теплоты поглощённое (принятое) телом из окружающей среды. (Дж)
Qпогл - количество теплоты поглощённое (принятое) телом из окружающей среды. (Дж)
Тепловое расширение
Линейное расширение:
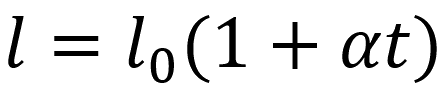
Пояснение:
l - длина тела (м)
l0 - исходная длина тела (м)
α - коэффициент линейного расширения материала (1/°C)
t - температура (°C)
(значения α в таблице)
l0 - исходная длина тела (м)
α - коэффициент линейного расширения материала (1/°C)
t - температура (°C)
(значения α в таблице)
Расширения площади поверхности:

Пояснение:
S - площадь поверхности (м²)
S0 - исходная площадь поверхности (м²)
α - коэффициент линейного расширения материала (1/°C)
t - температура (°C)
2αt — удвоенный эффект линейного расширения, так как площадь двумерная
(значения α в таблице)
S0 - исходная площадь поверхности (м²)
α - коэффициент линейного расширения материала (1/°C)
t - температура (°C)
2αt — удвоенный эффект линейного расширения, так как площадь двумерная
(значения α в таблице)
Объёмное расширение поверхности:
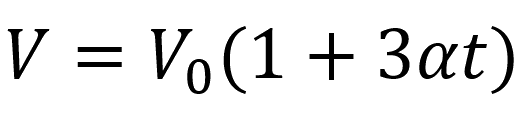
Пояснение:
V - объём поверхности (м³)
V0 - исходный объём поверхности (м³)
α - коэффициент линейного расширения материала (1/°C)
t - температура (°C)
3αt — утроенный эффект линейного расширения, так как площадь двумерная
(значения α в таблице 6)
V0 - исходный объём поверхности (м³)
α - коэффициент линейного расширения материала (1/°C)
t - температура (°C)
3αt — утроенный эффект линейного расширения, так как площадь двумерная
(значения α в таблице 6)
Законы термодинамики
Нулевой закон термодинамики:
Формулировка: если система A находится в тепловом равновесии с системой B, а система B— в тепловом равновесии с системой C, то системы A и C также находятся в тепловом равновесии.
Пояснение:
Суть: определяет понятие теплового равновесия и позволяет ввести шкалу температур.
Значение: обосновывает существование температуры как параметра состояния.
Значение: обосновывает существование температуры как параметра состояния.
Первый закон термодинамики:
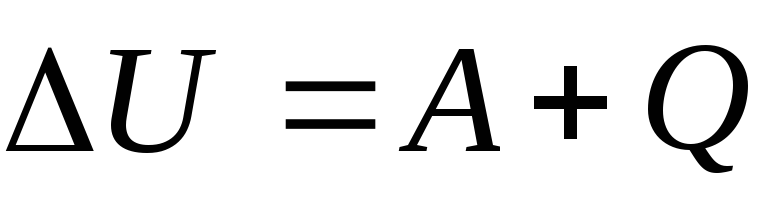
Пояснение:
ΔU - изменение внутренней энегрии (Дж)
A - работа над идеальным газом (Дж)
Q - количество теплоты (Дж)
A - работа над идеальным газом (Дж)
Q - количество теплоты (Дж)
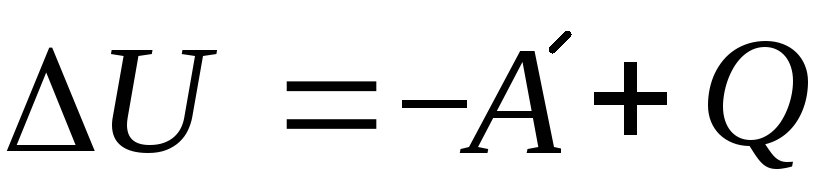
Пояснение:
ΔU - изменение внутренней энегрии (Дж)
A` - работа идеального газа (Дж)
Q - количество теплоты (Дж)
A` - работа идеального газа (Дж)
Q - количество теплоты (Дж)
Формулировка: изменение внутренней энергии системы (ΔU) равно сумме работы внешних сил (A) и количества теплоты (Q), переданного системе.
Суть: закон сохранения энергии для термодинамических систем.
Значение: исключает возможность вечного двигателя первого рода (который производит работу без затрат энергии).
Суть: закон сохранения энергии для термодинамических систем.
Значение: исключает возможность вечного двигателя первого рода (который производит работу без затрат энергии).
Применение закона термодинамики к изопроцессам:
T = const
Изотерм. процесс
Q = A`
Q - количество теплоты (Дж)
A` - работа идеального газа (Дж)
P = const
Изобарный процесс
Q = ΔU + A`
Q - количество теплоты (Дж)
ΔU - изменение внутренней энегрии (Дж)
A` - работа идеального газа (Дж)
V = const
Изохорный процесс
Q = ΔU
Q - количество теплоты (Дж)
ΔU - изменение внутренней энегрии (Дж)
Q = 0
Адиабатный процесс
A = ΔU
A - работа над идеальным газом (Дж)
ΔU - изменение внутренней энегрии (Дж)
Второй закон термодинамики:
Постулат Клаузиуса: теплота не может самопроизвольно переходить от более холодного тела к более горячему.
Постулат Кельвина‑Планка: невозможно создать циклическую машину, которая бы полностью превращала теплоту в работу без каких‑либо изменений в окружающих телах.
Энтропийная формулировка: в замкнутой системе энтропия либо возрастает (в необратимых процессах), либо остаётся постоянной (в обратимых процессах): ΔS≥0.
Суть: задаёт направленность термодинамических процессов и вводит понятие энтропии.
Значение: запрещает вечный двигатель второго рода (преобразующий теплоту в работу без потерь).
Третий закон термодинамики:
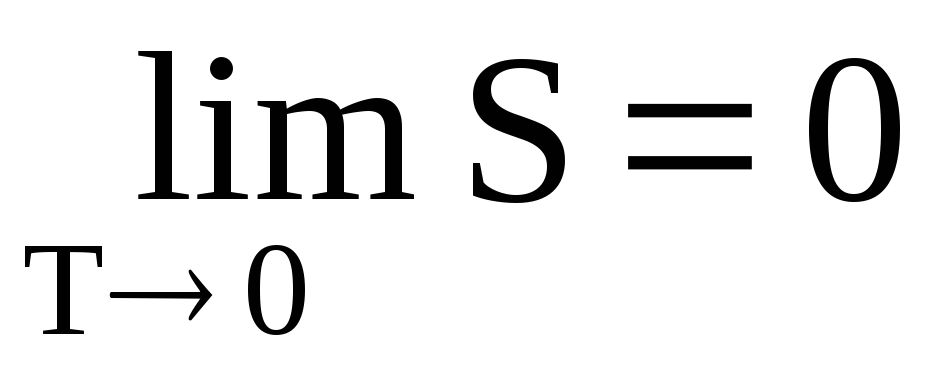
Пояснение:
lim T → 0 - стремлении температуры к 0
S - энтропия системы (Дж/К)
T - температура системы (K)
S - энтропия системы (Дж/К)
T - температура системы (K)
Формулировка: при стремлении температуры к абсолютному нулю (T→0 К) энтропия системы стремится к определённому пределу (обычно к нулю). Для идеальных кристаллов; в реальных системах могут быть исключения, например, стёкла.
Суть: описывает поведение энтропии при приближении к абсолютному нулю температуры.
Значение: позволяет определить абсолютное значение энтропии и установить недостижимость абсолютного нуля температуры.
Суть: описывает поведение энтропии при приближении к абсолютному нулю температуры.
Значение: позволяет определить абсолютное значение энтропии и установить недостижимость абсолютного нуля температуры.
Коэффицент полезного действия
КПД теплового двигателя через работу:
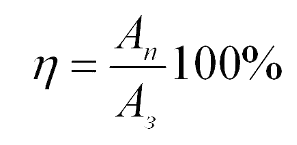
Пояснение:
η - коэффициент полезного действия (%)
An - полезная работа (Дж)
Aз - затраченная работа (Дж)
An - полезная работа (Дж)
Aз - затраченная работа (Дж)
КПД теплового двигателя через кол. теплоты:
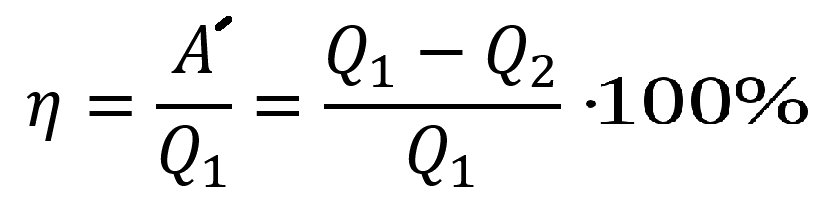
Пояснение:
η - коэффициент полезного действия (%)
A`- работа газа (Дж)
Q1 - кол. теплоты, получаемое от нагревателя (Дж)
Q2 - кол. теплоты, отданное холодильнику (Дж)
A`- работа газа (Дж)
Q1 - кол. теплоты, получаемое от нагревателя (Дж)
Q2 - кол. теплоты, отданное холодильнику (Дж)
КПД теплового двигателя через температуру:
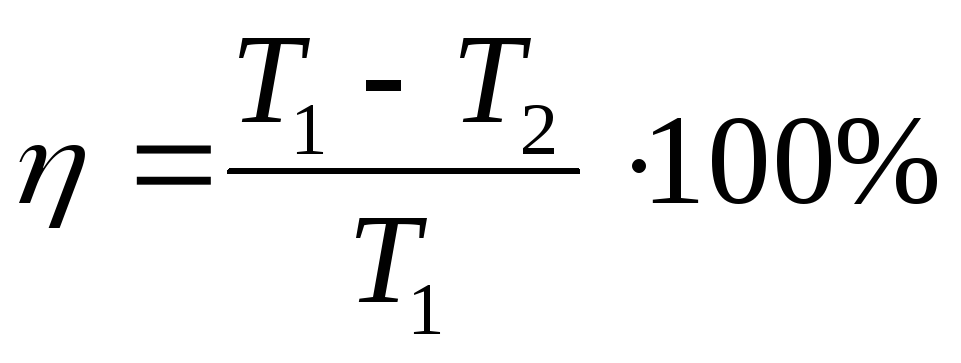
Пояснение:
η - коэффициент полезного действия (%)
T1 - температура нагревателя (Дж)
Q2 - температура холодильника (Дж)
T1 - температура нагревателя (Дж)
Q2 - температура холодильника (Дж)