 Разделы физики
Разделы физики
Молекулярная физика
Движение и взаимодействие частиц.
Основы МКТ
Относительная молекулярная масса:
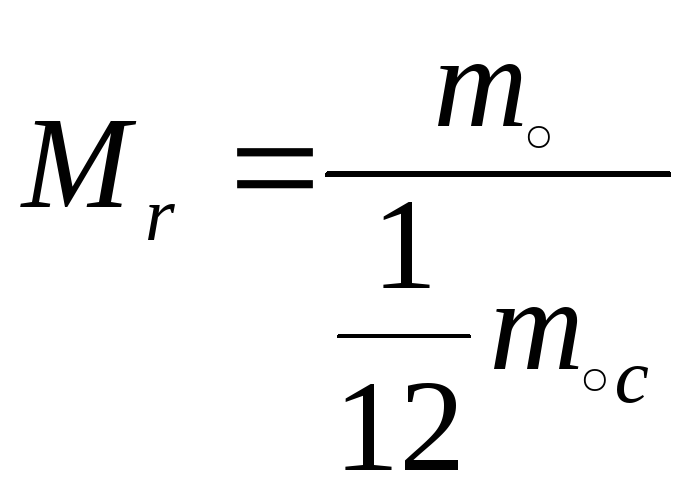
Пояснение:
Mr - относительная молекулярная масса
m0 - масса одной молекулы (кг)
m0C - масса одной молекулы углерода (кг)
m0 - масса одной молекулы (кг)
m0C - масса одной молекулы углерода (кг)
Масса одной молекулы:

Пояснение:
m0 - масса одной молекулы (кг)
N - число частиц
M - молярная масса вещества (кг/моль)
Na - постоянная Авогадро
(6,022 ⋅ 1023 моль-1)
N - число частиц
M - молярная масса вещества (кг/моль)
Na - постоянная Авогадро
(6,022 ⋅ 1023 моль-1)
Молярная масса:
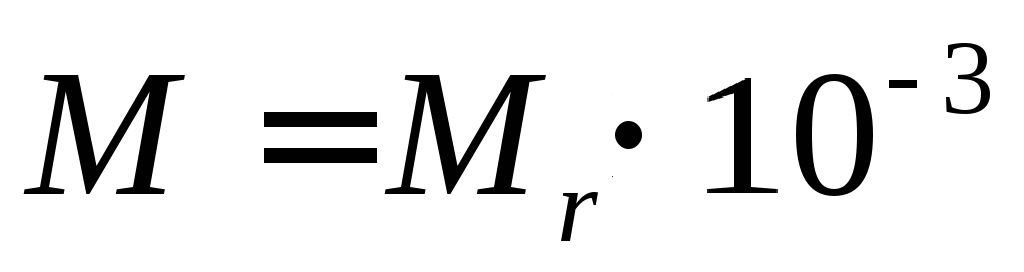
Пояснение:
M - молярная масса вещества (кг/моль)
Mr - относительная молекулярная масса
Mr - относительная молекулярная масса
Масса вещества:
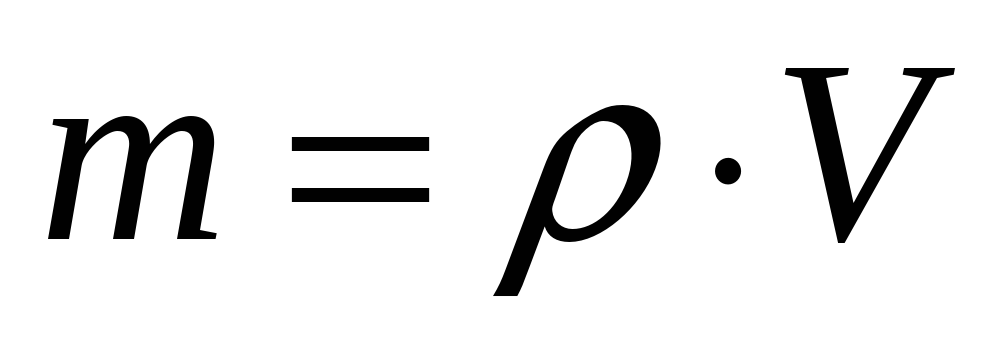
Пояснение:
m - масса вещества (кг)
ρ(ро) - плотность жидкости (кг/м³)
V - объём вещества (м³)
(значения ρ в таблице)
ρ(ро) - плотность жидкости (кг/м³)
V - объём вещества (м³)
(значения ρ в таблице)
Плотность:
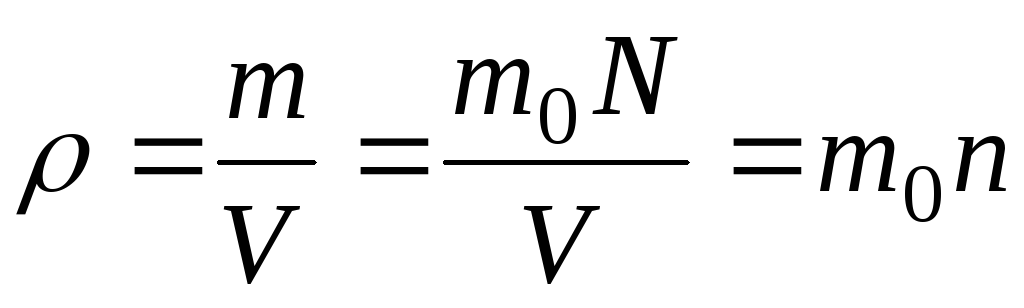
Пояснение:
ρ(ро) - плотность вещества (кг/м³)
m - масса газа (кг)
v - объём газа (м³)
m0 - масса одной молекулы (кг)
N - число частиц
υ(n) - количество вещества (моль)
(значения ρ в таблице)
m - масса газа (кг)
v - объём газа (м³)
m0 - масса одной молекулы (кг)
N - число частиц
υ(n) - количество вещества (моль)
(значения ρ в таблице)
Количество вещества через массу:
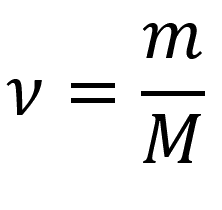
Пояснение:
υ(n) - количество вещества (моль)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
Количество вещества через число частиц:

Пояснение:
υ(n) - количество вещества (моль)
N - число частиц
Na - постоянная Авогадро
(6,022 ⋅ 1023 моль-1)
N - число частиц
Na - постоянная Авогадро
(6,022 ⋅ 1023 моль-1)
Количество вещества для газообразных веществ:
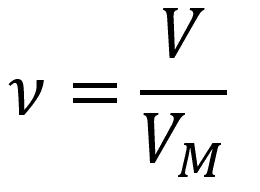
Пояснение:
υ(n) - количество вещества (моль)
V - объём газа при нормальных условиях (л)
Vm - молярный объём газа при н. у.
(22,4 л/моль)
V - объём газа при нормальных условиях (л)
Vm - молярный объём газа при н. у.
(22,4 л/моль)
Концентрация молекул:
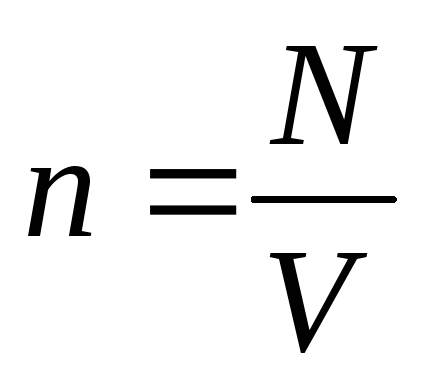
Пояснение:
n - концентрация молекул (м-3)
N - число частиц
V - объём газа (л)
N - число частиц
V - объём газа (л)
Основные уравнения МКТ
Давление идеального газа:
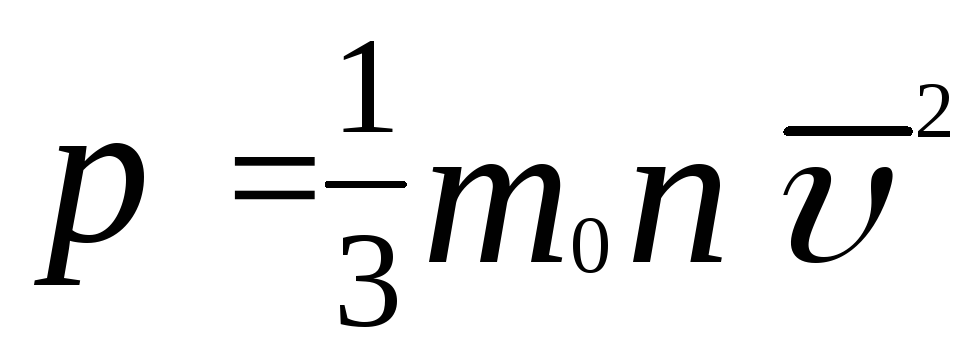
Пояснение:
p - давление (Па)
m0 - масса одной молекулы (кг)
n - концентрация молекул (м-3)
υ2 - средняя квадратичная скорость (м/с)
m0 - масса одной молекулы (кг)
n - концентрация молекул (м-3)
υ2 - средняя квадратичная скорость (м/с)
Давление идеального газа через температуру:

Пояснение:
p - давление (Па)
n - концентрация молекул (м-3)
k - постоянная Больцмана (≈ 1,38·10-23 Дж/К) T - температура газа (К)
n - концентрация молекул (м-3)
k - постоянная Больцмана (≈ 1,38·10-23 Дж/К) T - температура газа (К)
Давление идеального газа через среднюю кинетическую энергию:
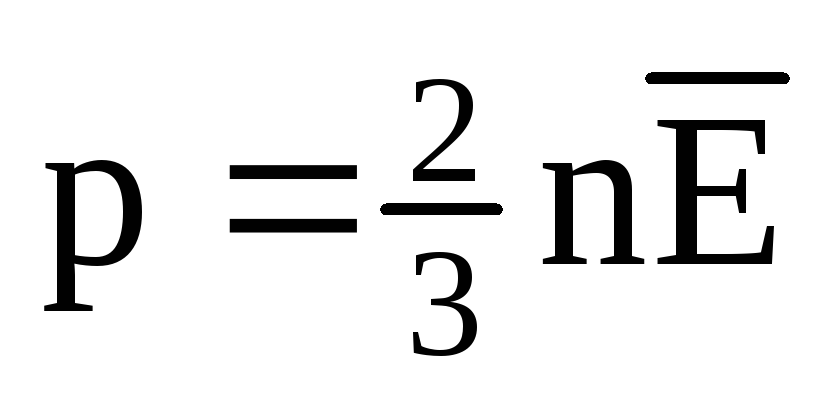
Пояснение:
p - давление (Па)
n - концентрация молекул (м-3)
Е - средняя кинетическая энергия (Дж)
n - концентрация молекул (м-3)
Е - средняя кинетическая энергия (Дж)
Средняя квадратичная скорость:
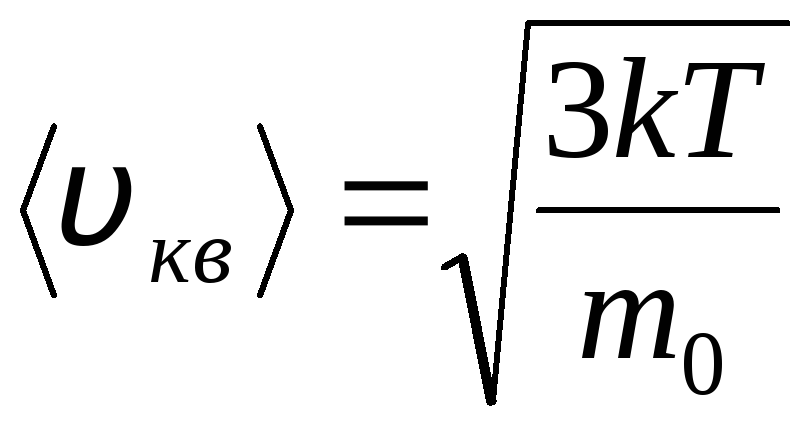
Пояснение:
<vкв> - средняя квадратичная скорость (м/с)
k - постоянная Больцмана (≈ 1,38·10⁻²³ Дж/К)
T - абсолютная температура газа (К)
m0 - масса одной молекулы (кг)
k - постоянная Больцмана (≈ 1,38·10⁻²³ Дж/К)
T - абсолютная температура газа (К)
m0 - масса одной молекулы (кг)
Средняя кинетическая энергия:
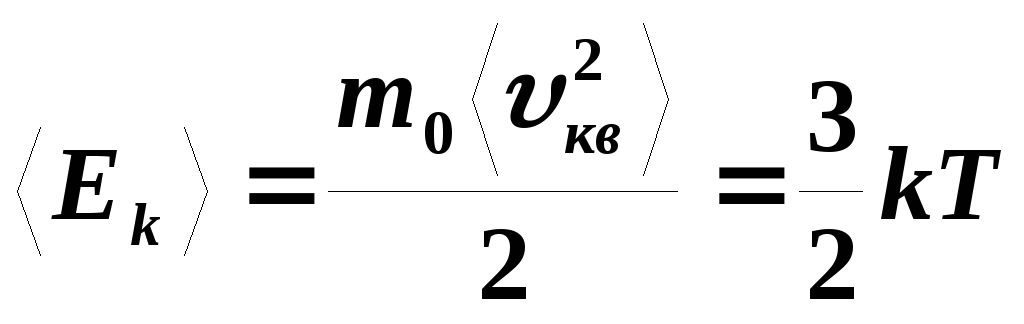
Пояснение:
<Е& - средняя кинетическая энергия (Дж)
m0 - масса одной молекулы (кг)
<vкв2> - средняя квадратичная скорость (м/с)
k - постоянная Больцмана (≈ 1,38·10⁻²³ Дж/К)
T - абсолютная температура газа (К)
m0 - масса одной молекулы (кг)
<vкв2> - средняя квадратичная скорость (м/с)
k - постоянная Больцмана (≈ 1,38·10⁻²³ Дж/К)
T - абсолютная температура газа (К)
Идеальный газ, газовые законы и их графики
Уравнения состояния идеального газа
(уравнение Менделева-Клапейрона):
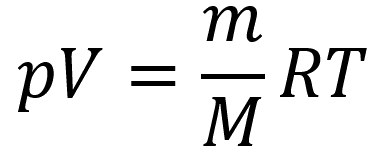
Пояснение:
p - давление (Па)
V - объём (м³)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
T - температура (К)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
V - объём (м³)
m - масса вещества (кг)
M - молярная масса вещества (кг/моль)
T - температура (К)
R - универсальная газовая постоянная
(≈ 8,31 Дж/(моль·К))
Уравнения Клапейрона:
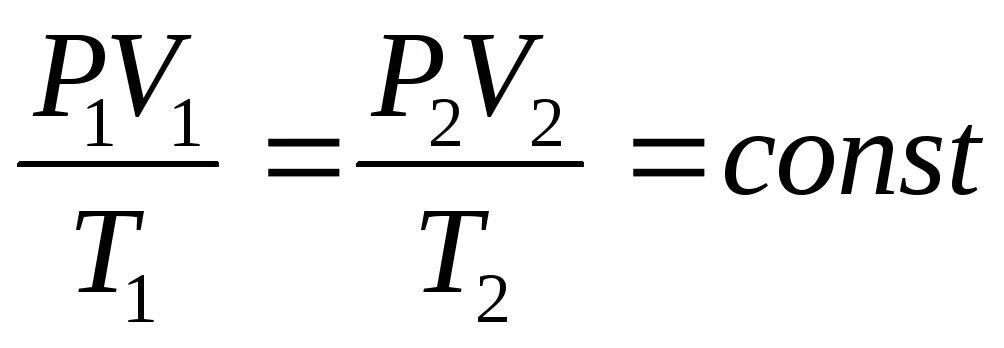
Пояснение:
P1 - начальное давление (Па)
V1 - начальный объём (м³)
T1 - начальная температура (К)
P2 - конечное давление (Па)
V2 - конечный объём (м³)
T2 - конечная температура (К)
V1 - начальный объём (м³)
T1 - начальная температура (К)
P2 - конечное давление (Па)
V2 - конечный объём (м³)
T2 - конечная температура (К)
Давление смеси газов (закон Дальтона):
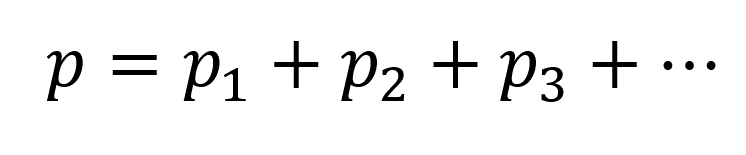
Пояснение:
- Общее давление смеси газов (p) равно сумме парциальных давлений каждого газа в смеси.
Газовые процессы(изопроцессы)
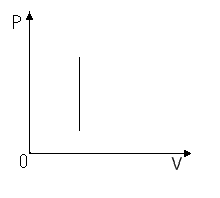
1. Изотермический процесс (закон Бойля-Мариотта):
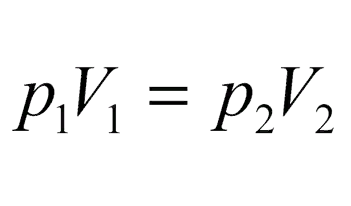
Пояснение:
P1 - начальное давление (Па)
V1 - начальный объём (м³)
P2 - конечное давление (Па)
V2 - конечный объём (м³)
T - const
V1 - начальный объём (м³)
P2 - конечное давление (Па)
V2 - конечный объём (м³)
T - const
Изотерма (P;V)
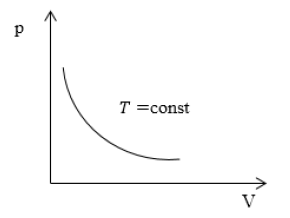
P обратно пропорционально V
Изотерма (V;T)
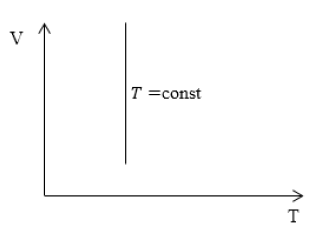
P обратно пропорционально V
Изотерма (P;T)
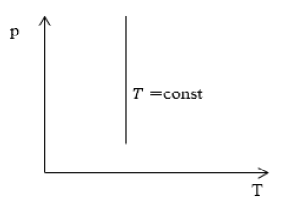
P обратно пропорционально V
2. Изобарный процесс (закон Гей-Люссака):
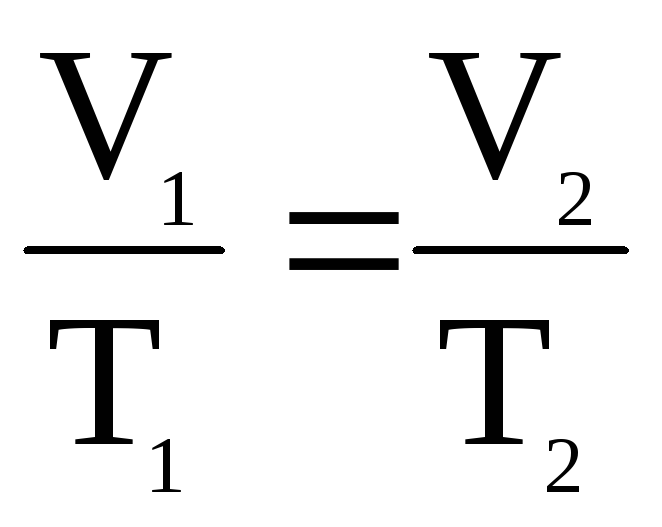
Пояснение:
V1 - начальный объём (м³)
T1 - начальная температура (К)
V2 - конечный объём (м³)
T2 - конечная температура (К)
P - const
T1 - начальная температура (К)
V2 - конечный объём (м³)
T2 - конечная температура (К)
P - const
Изобара (P;V)
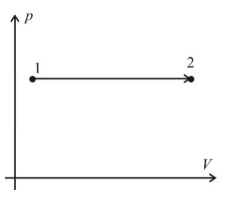
V прямо пропорционально T
Изобара (V;T)
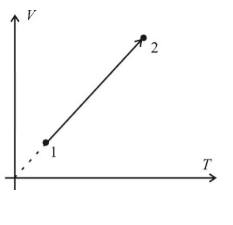
V прямо пропорционально T
Изобара (P;T)
V прямо пропорционально T
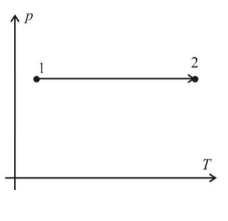
2. Изохорный процесс (закон Шарля):
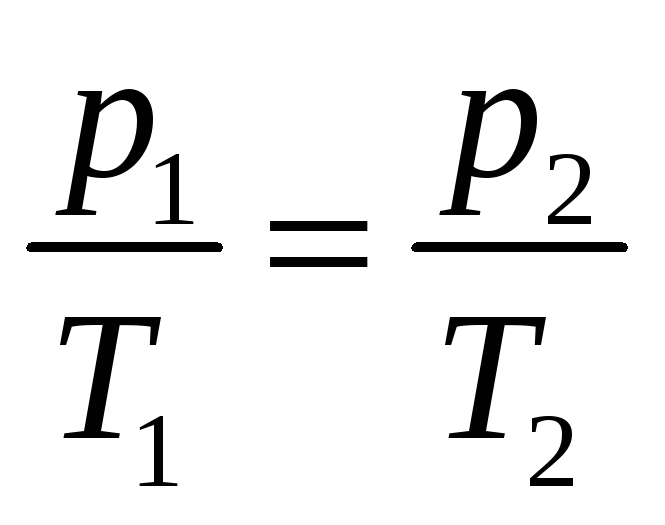
Пояснение:
P1 - начальное давление (Па)
T1 - начальная температура (К)
P2 - конечное давление (Па)
T2 - конечная температура (К)
V - const
T1 - начальная температура (К)
P2 - конечное давление (Па)
T2 - конечная температура (К)
V - const
Изохора (P;V)
P прямо пропорционально T
Изохора (V;T)
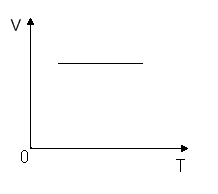
P прямо пропорционально T
Изохора (P;T)
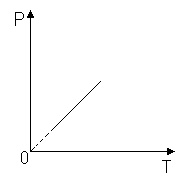
P прямо пропорционально T
Влажность воздуха
Относительная влажность:
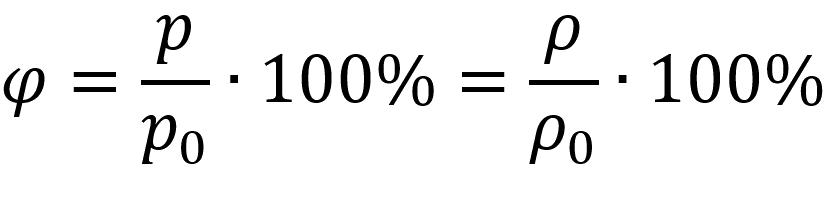
Пояснение:
p - давление водяного пара (Па)
p0 - давление насыщенного пара (Па)
ρ(ро) - плотность водяного пара (кг/м³)
ρ0 - плотность насыщенного пара (кг/м³)
p0 - давление насыщенного пара (Па)
ρ(ро) - плотность водяного пара (кг/м³)
ρ0 - плотность насыщенного пара (кг/м³)
Абсолютная влажность(плотность воздуха):
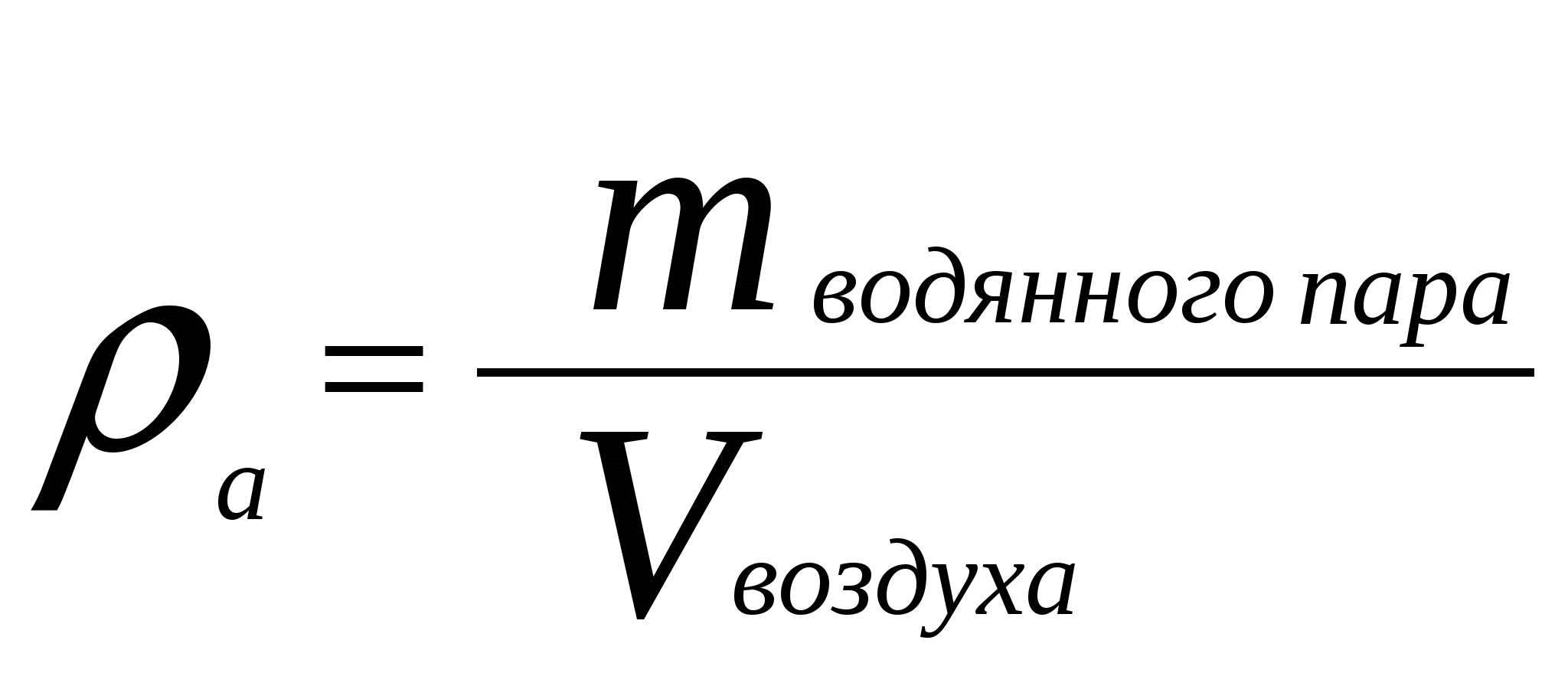
Пояснение:
ρа(ро) - плотность воздуха (кг/м³)
mв.п. - масса водяного пара (кг)
Vвоз. - объём воздуха (м³)
(значения ρ в таблице)
mв.п. - масса водяного пара (кг)
Vвоз. - объём воздуха (м³)
(значения ρ в таблице)